推荐产品
公司新闻/正文
慢病毒载体生产应用及慢病毒转染原理详解-赛默飞
136 人阅读发布时间:2025-09-16 15:40
最大限度提高滴度的慢病毒载体生产可扩展解决方案
无论您采用贴壁系统还是从事悬浮培养生产,病毒生产都会是您整体运营过程中价格不菲的一环。我们的目标是最大限度提高滴度,为您的病毒生产提供高性价比的可扩展解决方案。
我们致力于助力客户取得商业化成功,这也是我们不断开发新的解决方案,不断帮助您走在细胞和基因治疗最前沿的根本原因。
针对悬浮培养慢病毒生产进行了优化
-
Gibco LV-MAX 慢病毒生产体系
-
高滴度—超过1 x 108 TU/mL (未浓缩的LVVs-GFP)
-
可扩展的悬浮培养体系—规格可从96孔深孔板扩展到2L生物反应器
-
无血清—消除了动物源成份及相关的风险
-
GMP积极开发计划
Gibco LV-MAX 慢病毒生产体系是针对化学成分明确的无血清环境下的悬浮培养慢病毒生产进行过优化,包含最大限度提高生产所需的所有高质量成份的系统。
为改进慢病毒生产而优化的多成份体系
LV-MAX 慢病毒生产体系可提供可扩展、高产量的慢病毒载体生产平台。其基于在LV-MAX生产培养基中培养的HEK 293来源的病毒生产细胞高密度培养物。通过我们先进的脂质体纳米微粒 转染试剂结合新型的慢病毒特异性增强剂和添加剂(图1),调控实现最佳的慢病毒滴滴度。所有成份协同作用,相对于传统的(PEI)血清培养体系,有助于生成更优良的功能性慢病毒微粒(图2)。上述数据证明,相对于使用不完全的或未经优化的系统,我们的完整体系在提高慢病毒载体(LVV)方面的突出积极影响(图3)。
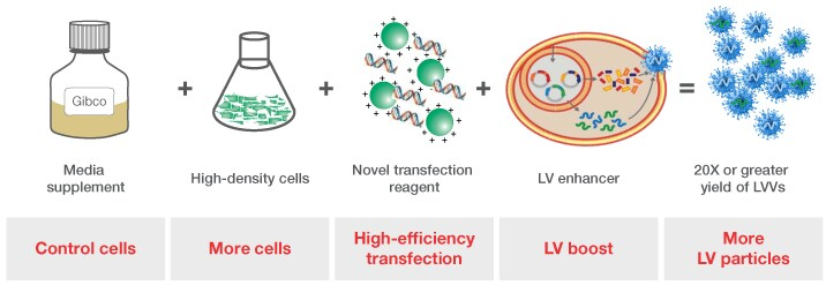
图 1.LV-MAX 慢病毒生产体系实验方案概览
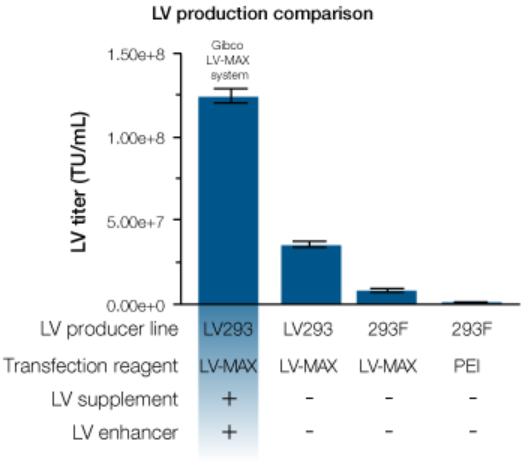
图 2:采用LV-MAX体系的病毒滴度显著提高采用我们的LV-MAX慢病毒生产体系或替代转染试剂和细胞,在30 mL摇瓶之中生产慢病毒。LV293 = Gibco 病毒生产细胞(HEK 293来源的悬浮细胞),293F = Gibco FreeStyle 293-F细胞系,PEI 。
以更低的成本实现更高产量的慢病毒生产
相对于基于PEI的系统,LV-MAX体系的贴壁细胞慢病毒产量提高近15倍,悬浮细胞慢病毒产量提高近10倍,且成本下降了50%以上。
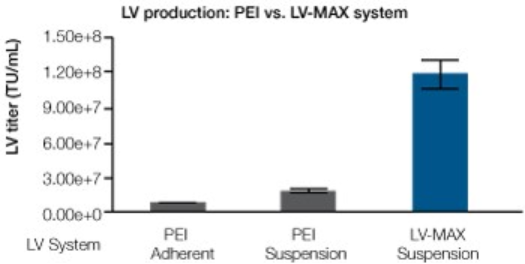

图 3.采用LV-MAX慢病毒生产体系,慢病毒产量大幅提升。采用LV-MAX慢病毒生产体系的悬浮细胞慢病毒产量(未过滤)与采用PEI介导的慢病毒载体转染方法的贴壁HEK 293T/FT 细胞和悬浮HEK293细胞慢病毒产量比较。通过转导HT1080细胞并分析GFP阳性细胞进行慢病毒滴度测定。同时展示了带来的成本节省情况。
更自信地规模化扩展
LV-MAX慢病毒生产体系支持在不同的悬浮培养皿中进行稳定的慢病毒生产。您可以根据自己在发现研究早期的需要扩大或缩小自己的规模以实现更高的通量,亦可在维持无血清体系高产量的前提下无缝、高效规模化扩展(图4)。无论何种规模,您均可更自信地开展生产。
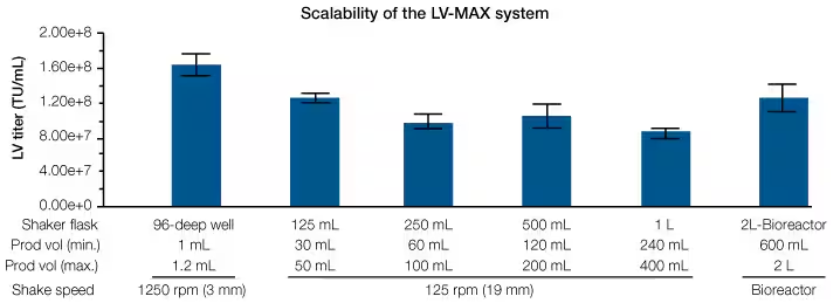 图 4.LV-MAX慢病毒生产体系在HEK 293来源的悬浮细胞之中的可扩展性。采用LV-MAX 慢病毒生产体系,通过96孔深孔板到2 L生物反应器,进行不同体积的慢病毒生产。通过转导HT1080细胞并分析GFP阳性细胞,测定慢病毒滴度;在不同体积规格下,观测到了相似的滴度。
图 4.LV-MAX慢病毒生产体系在HEK 293来源的悬浮细胞之中的可扩展性。采用LV-MAX 慢病毒生产体系,通过96孔深孔板到2 L生物反应器,进行不同体积的慢病毒生产。通过转导HT1080细胞并分析GFP阳性细胞,测定慢病毒滴度;在不同体积规格下,观测到了相似的滴度。
可实现出色的贴壁培养慢病毒生产的先进脂质体纳米微粒技术
Invitrogen Lipofectamine 3000转染试剂是高效、高性价比的慢病毒生产工具。即便是较大或难以包装的基因,通过这种多功能试剂亦可实现高病毒滴度。
Invitrogen Lipofectamine 3000试剂
-
高滴度—涵盖了较大或难以包装的基因
-
作用温和—减少了试剂用量,提高了细胞活力
-
灵活—与我们现有的实验方案兼容
-
性价比高—所需的辅助试剂和人力成本更少
Lipofectamine 3000试剂、Lipofectamine 2000试剂和PEI的平行比较结果显示,Lipofectamine 3000试剂介导的慢病毒生产产量相对于其他转染试剂提高了约5–10倍(图5)。
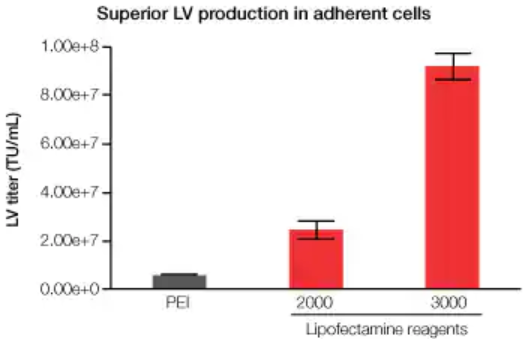
图 5.采用Lipofectamine 3000试剂进行的贴壁细胞慢病毒生产。分别将Lipofectamine 3000试剂、Lipofectamine 2000试剂和PEI加入到含HEK 293T/FT细胞的6孔培养板中,获得pLenti6.3/V5-GW/EmGFP和Invitrogen ViraPower慢病毒包装混合物。转导HT1080细胞并分析GFP阳性细胞,测定慢病毒滴度。
病毒转染原理及步骤
对于不适合脂质体介导转染的细胞类型,通常使用病毒载体进行转染。病毒介导转染也称为转导,这种转染方式可在难以转染的细胞类型中实现蛋白过表达或敲低,是临床研究中最常用的方法(Glover 等人,2005;Pfeifer 和 Verma,2001)。腺病毒、致癌逆转录病毒和慢病毒载体已广泛用于哺乳动物细胞培养物和体内的基因递送。病毒基因转移的其他知名示例包括基于杆状病毒和牛痘病毒的载体。有关各种病毒递送系统的更多信息,请参见病毒载体。
虽然病毒能整合到宿主基因组中,体内转染效率高且能持续基因表达,因而成为临床试验中基因递送的系统,但也存在许多缺点,包括其免疫原性和细胞毒性、载体方面存在技术挑战且生产程序耗时费力、生物安全要求导致高成本、低包装能力(大多数病毒载体约为 10 kb,而非病毒载体约为 100 kb)以及病毒载体制剂的感染性存在变异性(Glover 等人,2005;Kim 和 Eberwine,2010;Vorburger 和 Hunt,2002)
典型的转导方案涉及改造携带转基因的重组病毒、在包装细胞系中扩增重组病毒颗粒、纯化和滴定扩增后的病毒颗粒以及随后感染目标细胞。虽然在原代细胞和细胞系中实现的转导效率相当高(约为 90%-100%),但只有携带病毒特异性受体的细胞才能被病毒感染。同样重要的是应注意,用于病毒扩增的包装细胞系需要用非病毒转染方法转染。
病毒递送操作流程
步骤一:生成病毒
通过基因克隆生成重组病毒。
步骤二:非病毒转染
使用非病毒方法转染包装细胞系以扩增和分离病毒载体。
步骤三:病毒纯化
纯化并滴定含转基因的病毒载体。
步骤四:感染和病毒清除
以适当的感染复数 (MOI) 感染目标细胞(含病毒特异性受体)。
从培养物中去除病毒和/或加入新鲜培养基。
步骤五:检测细胞
检测转导后细胞的基因表达或沉默情况。
如需合作转载本文,请文末留言。
#慢病毒载体# #慢病毒转染# #慢病毒# #慢病毒转染细胞#

















